Cтраница 1
Нейтральные жиры (одна из подгрупп липидов) являются богатым источником энергии: из 1 г жира при окислении выделя ется 9.3 ккал тепла, а в то же время такое количество углеводов дает всего лишь 4.2 ккал энергии. Жиры входят в состав прото плазмы клеток, а также предохраняют организм от охлаждения. Они растворяют жирорастворимые витамины. Жиры, обволаки вая внутренние органы, предохраняют их от сотрясений.
Нейтральные жиры обычно омыляют едкими щелочами, обеспечивающими достаточную скорость реакции при температуре до 100 С.
Нейтральные жиры являются сложными эфирами глицерина и карбоновых кислот; они называются глице-ридами.
Нейтральные жиры играют большую роль в живом организме. Они являются богатым источником энергии: 1 г жира выделяет при окислении 9 3 ккал тепла; жиры растворяют жирорастворимые витамины. Жиры входят в состав протоплазмы клеток; они являются запасным питательным материалом. Жировая ткань, обволакивая внутренние органы, предохраняет их от сотрясения. Подкожная жировая клетчатка предохраняет организм от охлаждения.
Нейтральные жиры (триглицериды), в особенно больших количествах откладывающиеся в вакуолях дрожжей и других грибов, сходны с жирами высших организмов. Дрожжи (Candida, Rhodotorula) могут накапливать до 80 % жиров по отношению к сухому веществу.
Нейтральные жиры, или тригли-цериды, представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот.
Нейтральные жиры, или триглицериды, представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот.
Нейтральные жиры (триглицериды) состоят из трех молекул жирных кислот, химически связанных с одной молекулой глицерина IB виде сложного эфира. Свойства жиров определяются свойствами жирных ишелот, входящих в их состав.
Нейтральные жиры при обычно применяемом в промышленности вакууме не перегоняются - и при высоких температурах дистилляции начинают разлагаться раньше, чем достигают температуры-кипения. Для получения более низкокипящих жирных кислот жяры гидролизуют, обрабатывая их водой три напрева-ниги и перемешивании. Молекула жира, присоединив три молекулы воды, расщепляется ща глицерин и три молекулы жирных кислот. Процесс гидролиза (разделения) жиров на жирные кислоты и глицерин в технике называется (расщеплением или омылением жиров.
Общие понятия.
Жиры - сложные эфиры глицерина и высокомолекулярных жирных кислот.
В состав жиров входят многочисленные предельные (или насыщенные) и непредельные (или ненасыщенные) жирные кислоты. Среди предельных кислот чаще встречаются стеариновая (С17Н35СООН) и пальмитиновая (С15Н31СООН). Из непредельных жирных кислот основная роль принадлежит олеиновой (С17Н33СООН), линолевой (С17Н31СООН) и линоленовой (С17Н29СООН), большое физиологическое значение имеет также арахидоновая (С19Н31СООН) кислота. Непредельные жирные кислоты характеризуются наличием двойных связей: в молекуле олеиновой кислоты содержится одна двойная связь, в молекуле линолевой - две, линоленовой - три, арахидоновой - четыре. Благодаря наличию двойных связей непредельные кислоты отличаются высокой реакционной способностью. Линолевая, линоленовая и арахидоновая (так называемые иолиненасьиценные) кислоты не синтезируются в организме человека и должны поступать с пищей. Недостаток этих кислот в пище вызывает серьезные нарушения обмена веществ, исчезающие при потреблении продуктов, в состав которых входят непредельные жирные кислоты. Поэтому указанные соединения относят к веществам, обладающим витаминным действием (витамин F). Линолевая и линоленовая кислоты содержатся в растительных маслах (льняном, подсолнечном и др.), арахидоновая кислота - в печеночных жирах рыб, сливочном масле и некоторых видах маргарина.
В состав масел некоторых тропических растений входят также циклические жирные кислоты (хаульмугро-вая, гиднокарповая и др.).
Качественные реакции на жиры.
Образование масляного пятна. Каплю масла наносят стеклянной палочкой на кусочек бумаги. Образуется пятно, не исчезающее при нагревании.
Растворимость жиров. Реактивы: а) растительное масло (подсолнечное, льняное, хлопковое или другое); б) твердый жир (бараний, говяжий); в) диэти-ловый эфир; г) ацетон; д) этиловый спирт; е) дистиллированная вода.
Ставят два ряда пробирок по 4 в каждом. В пробирки первого ряда вносят по нескольку капель растительного масла, в пробирки второго ряда- по кусочку твердого жира. В первую пробирку каждого ряда наливают 2 мл дистиллированной воды, во вторую - столько же диэтилового эфира, в третью - ацетона, четвертую - спирта. Все пробирки взбалтывают и наблюдают растворимость жиров в различных растворителях. Пробирки со спиртом рекомендуется подогреть на водяной бане. Записывают результаты опыта.
Эмульгирование жирных масел. Реактив растительное масло; б) углекислый натрий, 2%-ный раствор; в) мыло, 2%-ный раствор; г) желчь; д) дистиллированная вода.
В четыре пробирки вносят по 5 капель масла. В первую пробирку добавляют 2 мл дистиллированной воды, во вторую - 2 мл 2%-ного раствора углекислого натрия (соды), в третью - столько же 2%-ного раствора мыла, в четвертую - воды и несколько капель желчи. Все пробирки взбалтывают и наблюдают образование в первой пробирке неустойчивой эмульсии масла в воде, быстро расслаивающейся при стоянии, а в остальных - устойчивой эмульсии благодаря действию добавленных эмульгаторов, которые адсорбируются в наружном слое жировых капель и понижают их поверхностное натяжение.
Акролеиновая реакция. С помощью пробы на акролеин определяют наличие глицерина в жирах. При нагревании жира с кислым сернокислым калием натрием или борной кислотой происходит отщепление от молекулы глицерина двух молекул воды и образование акрилового альдегида, или акролеина, обладающего резким раздражающим запахом (пригоревшего сала):
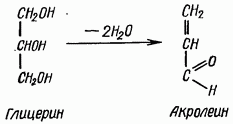
Глицерин Акролеин
Реактивы: а) растительное масло или животный жир; б) воск пчелиный; в) кислый сернокислый калий или натрий, кристаллический; г) борная кислота, кристаллическая.
В сухую пробирку вносят несколько капель растительного масла или кусочек животного жира, добавляют немного порошка кислого сернокислого калия (или натрия) или борной кислоты и осторожно подогревают. Появляются белые пары акролеина, обладающие резким запахом. Повторяют реакцию с воском - акролеин не образуется, так как глицерин не входит в состав восков.
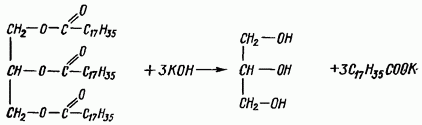
Омыление жира. При взаимодействии жиров со щелочами происходит их гидролиз с образованием солей высших жирных кислот (мыла) и глицерина. Натриевые соли представляют собой твердые мыла, калийные - жидкие. Реакция идет по уравнению
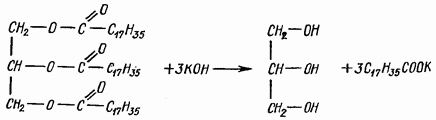
Реактивы: а) растительное масло или животный жир; б) кали едкое, 30%-ный спиртовой раствор; в) дистиллированная вода.
В широкую пробирку вносят 0,5 мл растительного масла или около 0,5 г животного жира и добавляют 10 мл спиртового раствора едкого кали. Пробирку закрывают пробкой с воздушным холодильником и нагревают на кипящей водяной бане в течение 30 мин., после чего в пробирку наливают горячую воду и растворяют в ней мыло.
Выделение свободных жирных кислот. Реактивы: а) раствор мыла (см. предыдущую работу); б) соляная кислота (1:1 по объему).
К 5 мл раствора мыла добавляют 1-2 мл раствора соляной кислоты. При взаимодействии сильной кислоты с мылом выделяются свободные жирные кислоты, которые всплывают на поверхность жидкости. Реакция идет по следующему уравнению:
Образование нерастворимых мыл. Кальциевые и магниевые соли жирных кислот нерастворимы в воде.
Реактивы: а) раствор мыла (см. работу «Омыление жира»); б) хлористый кальций, 5-10%-ный раствор.
К 2-3 мл раствора калийного мыла добавляют 1 мл раствора хлористого кальция. Выпадает нерастворимый в воде осадок стеарата кальция
Проба на непредельные жирные кислоты. Непредельные жирные кислоты способны присоединять галоиды по месту двойных связей:

Реактивы: а) растительное масло; б) бромная вода (хранят под тягой!); в) диэтиловый эфир или хлороформ.
В пробирку наливают 1-2 мл масла, растворяют его в 2-3 мл диэтилового эфира или хлороформа, прибавляют 1-2 капли бромной воды и взбалтывают. Буроватожелтая окраска бромной воды исчезает, что указывает на присутствие непредельных кислот.
Количественное определение жира. В основу многочисленных методов определения содержания жира в биологическом материале положена способность липидов растворяться в органических растворителях (диэтиловом и петролейном эфире, четыреххлористом
углероде, дихлорэтане, хлороформе и др.). При экстрагировании органическими растворителями в раствор переходят не только жиры, но также свободные жирные кислоты, фосфолипиды, стерины, воска, эфирные масла, пигменты (например, хлорофилл) и ряд других веществ, поэтому продукт, получаемый в результате анализа, называют «сырым жиром» или «суммой липидов». Для практических целей этот показатель обычно является достаточным, в случае же необходимости более точного определения «истинного жира» приходится в отдельных пробах материала исследовать содержание фосфолипидов (по фосфору), эфирных масел (перегонкой с водяным паром), свободных жирнкх кислот (тит-риметрическим методом) и т. д. и вносить соответствующие поправки в результаты анализа.
Приводим метод определения «сырого жира» в семенах масличных культур (по С. В. Рушковскому), нашедший широкое применение в лабораторной практике.
Реактивы и материалы; а) диэтиловый эфир. Для экстракции жира употребляют безводный эфир. В склянку с продажным эфиром прибавляют прокаленный хлористый кальций или негашеную известь (окись кальция). Сосуд укупоривают корковой пробкой, в которую вставляют трубку с прокаленным хлористым кальцием. По истечении 1-2 суток эфир сливают и к нему прибавляют новую порцию негашеной извести или хлористого кальция. Через 6-8 ч эфир сливают в сосуд, на дно которого кладут кусочки металлического натрия. Эфир должен быть также свободным от перекисей. Для этого к 1 л эфира добавляют раствора марганцовокислого калия и 10 мл 40%-ного раствора едкого кали или едкого натра, смесь осторожно взбалтывают и ставят в темное место на 20-24 ч, после чего разделяют в делительной воронке. Нижний слой, водный, отделяют, а верхний, эфирный, несколько раз промывают дистиллированной водой и затем обезвоживают, как описано выше. Внимание! Диэтиловый эфир легко воспламеняется, его пары образуют с воздухом взрывоопасные смеси, поэтому все работы надо проводить при строжайшем соблюдении противопожарных мероприятий. Целесообразно заменять диэтиловый эфир невоспламеняющимся растворителем, например четыреххлористым углеродом или хлороформом;
б) фосфорнокислый натрий двузамещенный, безводный, или сернокислый натрий, безводный. Кристаллическую соль высушивают в течение 6-8 ч при 100-105° С. Сернокислый натрий прокаливают в муфельной печи в течение семена льна, конопли, подсолнуха, рапса, кунжута.
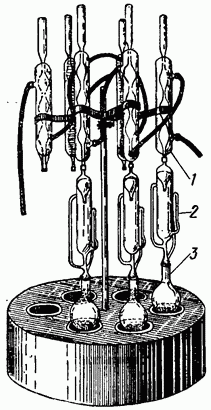
Рис. 11. Экстракционный аппарат Сокслета.
Аппаратура: а) экстракционный аппарат Сокслета (рис. 11). Состоит из трех частей, пришлифованных друг к другу: холодильника шарикового или спирального 1, экстрактора 2 и приемной колбы 3.
Берут 2-3 навески семян но 2-5 г (в зависимости от предполагаемого содержания масла). Навеску переносят в сухую фарфоровую ступку и растирают с безводным сернокислым натрием или фосфорнокислым натрием двузамещенным до получения однородной порошковидной массы. Соли берут в три раза больше по отношению к навеске.
Тщательно растертую массу количественно переносят в пакетик из фильтровальной бумаги, высушенной до постоянного веса. Пакетик заворачивают, как порошок в аптеке, взвешивают на аналитических весах и переносят в экстрактор аппарата Сокслета.
Примечание. В экстрактор можно поместить 4-6 пакетиков.
В приемную колбу наливают эфир (или другой растворитель) на емкости, после чего ее соединяют с экстрактором. В экстрактор наливают столько эфира, чтобы его уровень покрывал пакетики и почти доходил до верхней части сифона, затем с помощью шлифа соединяют его с холодильником и аппарат ставят на холодную водяную баню. Материал настаивают в растворителе
не менее 3-4 ч и лишь после этого включают источник нагрева.
Примечание. Аппараты Сокслета следует установить в вытяжном шкафу. Еще раз подчеркиваем необходимость тщательного соблюдения всех противопожарных мероприятий. Во время заливки эфира выключают все электроприборы в лаборатории.
Пары эфира из приемной колбы по широкой трубке поступают в холодильник, где они конденсируются, и капли растворителя стекают в экстрактор, извлекая жир из растертых семян. Как только уровень эфира достигнет верхнего края сифонной трубки, он тотчас же начнет переливаться в приемную колбу. Таким образом, процесс экстракции продолжается непрерывно. Диэтиловый эфир кипит при температуре 34-35° С, поэтому надо так отрегулировать нагрев, чтобы в течение часа происходило не более 8-10 сливаний растворителя через сифонную трубку.
Экстракцию жира продолжают 5-6 ч (не считая времени настаивания), после чего пакетики с обезжиренным материалом вынимают из экстрактора, подсушивают на стекле в вытяжном шкафу (до испарения эфира) и высушивают (во взвешенных бюксах) при 100-105° С до постоянного веса. Содержание масла в семенах (в процентах на сухое вещество) рассчитывают, зная вес пакетика до и после экстракции, а также вес пустого пакетика. Берут среднее из 3-4 определений.
Определение химических показателей жиров.
По своему составу природные жиры весьма неоднородны. Они состоят из смеси триглицеридов различных предельных и непредельных жирных кислот. Кроме того, в их состав входят также моно- и диглицериды, свободные жирные кислоты, пигменты, жирорастворимые витамины, некоторая примесь белковых веществ. Нейтральным жирам обычно сопутствуют липоиды (фосфатиды, стерины, стериды и т. д.).
Растительные жиры (называемые обычно маслами) характеризуются жидкой консистенцией. В их состав входят главным образом непредельные кислоты. Масло какао и кокосовое - твердые.
Жиры животного происхождения - преимущественно твердые, так как состоят в основном из глицеридов предельных жирных кислот. Животные жиры жидкой консистенции
Жиры характеризуются рядом химических показателей. Основные из них: кислотное число, число омыления, эфирное число, йодное число.
Примечание. Для более подробной характеристики химических свойств жнров определяют также содержание летучих кислот (растворимых и нерастворимых в воде), окснкислот (ацетильное число), родановое и гексабромное числа и некоторые другие показатели, рассмотрение которых не входит в задачи нашего практикума.
При хранении жира под влиянием кислорода воздуха, влаги и солнечного света, при участии органических катализаторов-ферментов происходит его порча, прогоркание. Растительные масла, богатые непредельными кислотами, прогоркают быстрее, чем твердые жиры. Степень устойчивости жиров при хранении характеризуют перекисное число и содержание альдегидов. В значительной мере об этом свидетельствует и кислотное число, так как при порче происходит гидролитический распад триглицеридов и высвобождение свободных жирных кислот.
Кислотное число. Кислотным числом называется количество миллиграммов едкого кали, необходимое для нейтрализации свободных жирных кислот, содержащихся в 1 г жира.
Реактивы: а) едкое кали, 0,1 н спиртовой раствор;
б) смесь этилового спирта с диэтиловым эфиром (1:1);
в) фенолфталеин, 1%-ный спиртовой раствор; г) тимол-фталеин, 1%-ный спиртовой раствор.
В сухую коническую колбу (емкостью 250 мл) отвешивают 3-5 г жира. Навеску растворяют в 50 мл предварительно нейтрализованной смеси спирта с эфиром.
Примечание. Смесь спирта с эфиром нейтрализуют 0,1 н спиртовым раствором едкого калн (в присутствии 3-4 капель раствора фенолфталеина) до слаборозового окрашивания и лишь после этого вливают в колбу с навеской жнра.
Раствор жира титруют 0,1 н спиртовым раствором едкого кали (индикатор - фенолфталеин) до появления розовой окраски, не исчезающей в течение 0,5-1 мин.
При определении кислотного числа темноокрашенных жиров вместо фенолфталеина пользуются 1%-ным спиртовым
раствором тимолфталеина (в кислой среде - бесцветен, в щелочной - голубое окрашивание).
Кислотное число к. ч. вычисляют по формуле
![]()
где в - количество 0,1 н спиртового раствора едкого кали, израсходованное на титрование навески жира, мл; к - поправочный коэффициент к титру 0,1 н раствора КОН; 5,611 - титр точно 0,1 н раствора КОН; н - навеска жира, г.
Для характеристики кислотности растительных масел, кроме кислотного числа, часто рассчитывают процентное содержание свободной олеиновой кислоты О по формуле
![]()
где к. ч. - кислотное число масла, мг.
Число омыления. Число омыления показывает, сколько миллиграммов едкого кали надо израсходовать для нейтрализации как свободных, так и связанных (в эфиры) кислот, содержащихся в 1 г жира.
Реактивы: а) растительное масло или животный жир; б) едкое кали, 0,5 н спиртовой раствор: 29-30 г гранулированного едкого кали растворяют в 25-30 мл воды, после чего для осаждения карбонатов прибавляют несколько миллилитров 35-40%-ного раствора хлористого бария и раствор в литровой мерной колбе доводят этиловым спиртом - ректификатом до метки. Хранят в хорошо укупоренной склянке оранжевого стекла. Для защиты от проникновения углекислоты воздуха склянку снабжают хлоркальциевой трубкой с натронной известью; в) соляная кислота, 0,5 н раствор; г) фенолфталеин, спиртовой раствор.
Коническую колбу (емкостью 250 мл) взвешивают на аналитических весах, затем в нее вносят около 2 г растительного масла или животного жира и снова взвешивают. По разности устанавливают навеску жира. В колбу с помощью пипетки с резиновой грушей вливают 25 мл 0,5 н спиртового раствора КОН, укупоривают пробкой с обратным холодильником и нагревают на водяной бане 35-40 мин., время от времени взбалтывая содержимое колбы. При омылении жира не следует допускать бурного
кипения воды в бане, которое может явиться причиной вспенивания жидкости в колбе и попадания ее на пробку. К концу процесса омыления раствор в колбе становится однородным, прозрачным, без капелек жира.
Горячий мыльный раствор в колбе оттитровывают 0,5 н соляной кислотой (индикатор - фенолфталеин) до обесцвечивания розовой окраски. Параллельно проводят контрольный опыт с тем же количеством 0,5 н спиртового раствора КОН, но без добавления жира. Контрольный опыт необходим для проверки титра раствора КОН, так как вследствие частичного проникновения углекислоты воздуха и окисления этилового спирта титр может меняться.
Число омыления о. рассчитывают по формуле
![]()
где с - количество 0,5 н раствора соляной кислоты, израсходованное на титрование контрольного («слепого») опыта, мл; - количество 0,5 н раствора соляной кислоты, израсходованное на титрование испытуемого образца, к - поправочный коэффициент к титру приблизительно 0,5 н спиртового раствора КОН; 28,055 - титр точного 0,5 н раствора КОН (1 мл раствора содержит 28,055 мг КОН); н - навеска жира, г.
Эфирное число. Эфирным числом называют количество миллиграммов едкого кали, которое требуется для нейтрализации жирных кислот, связанных в виде эфиров в 1 г жира.
Эфирное число э. ч. определяют расчетным путем, вычитая кислотное число из числа омыления:
Таким образом, число омыления является суммой кислотного и эфирного чисел.
Определение количества глицерина в жире.
Химическое определение содержания глицерина в жирах является довольно трудоемким и продолжительным. Сравнительно неплохие результаты дает расчетный метод. Зная эфирное число жира, можно вычислить содержание глицерина, приняв во внимание, что для высвобождения одной молекулы глицерина надо израсходовать три молекулы едкого кали
Процентное содержание глицерина в жире г рассчитывают по формуле
![]()
где 92,06 - молекулярный вес глицерина; э. ч. - эфирное число жира; 56,11 - молекулярный вес едкого кали.
Иодное число.
Общие сведения. Иодное число показывает количество граммов иода, которое присоединяется к 100 г жира. Оно свидетельствует о количественном содержании непредельных кислот в жире, что позволяет судить о его устойчивости к окислению, полимеризации и другим превращениям. Йодное число является показателем, характерным для каждого вида свежего жира.
Химизм процесса присоединения галоидов описан выше (см. «Проба на непредельные жирные кислоты»). Следует подчеркнуть, что иод присоединяется главным образом к двойным связям, тогда как более реакционноспособные галоиды - хлор и бром - могут также замещать атомы водорода в углеводородном радикале кислоты.
Наиболее точным является определение йодного числа то Гюблю, однако оно связано с применением весьма ядовитого реактива - сулемы и поэтому не может быть рекомендовано для студенческого практикума. Описываем более простой и быстрый метод определения йодного числа, применение которого не связано с использованием сулемы. Метод обладает вполне удовлетворительной точностью.
Определение йодного числа с бромистым иодом (по Ганусу). Бромистый иод образуется при взаимодействии иода с бромом в уксуснокислой среде.
Бромистый иод количественно присоединяется к непредельным жирным кислотам по месту двойных связей.
Избыток бромистого иола, не вошедший в реакцию, реагирует с иодистым калием по уравнению
Выделившийся иод оттитровывают тиосульфатом
Реактивы: а) растительное масло; б) реактив Гануса: 13 г кристаллического иода растворяют в 100 мл ледяной уксусной кислоты (в мерной колбе емкостью . К раствору добавляют 8,2 г брома и доводят ледяной уксусной кислотой до 1 л. Хранят в склянке оранжевого стекла с притертой пробкой. Раствор готовится лаборантом (в вытяжном шкафу!); в) иодистый калий, 20%-ный раствор. Готовится непосредственно перед определением; г) тиосульфат натрия (гипосульфит, серноватистокислый натрий), 0,1 н раствор; д) крахмал, 1%-ный раствор; е) хлороформ.
В сухую коническую колбу или склянку с притертой пробкой емкостью 250-300 мл отвешивают на аналитических весах 0,2-0,3 г масла и растворяют его в 10 мл хлороформа. В другую такую же колбу или склянку вносят 10 мл хлороформа без масла («слепой опыт»), В обе колбы из бюретки (со стеклянным краном) добавляют по 25 мл реактива Гануса. Сосуды плотно закрывают пробками, смоченными в растворе иодистого калия. Содержимое сосудов осторожно взбалтывают, после чего сосуды ставят в темное место на 1-1,5 ч. По истечении указанного времени в оба сосуда добавляют по 10 мл 20%-ного раствора иодистого калия и 50 мл воды и выделившийся иод оттитровывают 0,1 н раствором тиосульфата натрия до слабо-желтой окраски, потом добавляют 10-12 капель раствора крахмала и продолжают титрование до полного обесцвечивания раствора.
При расчетах принимают во внимание, что 1 мл 0,1 н раствора тиосульфата натрия соответствует 1 мл 0,1 н раствора иода. Йодное число и. ч. вычисляют по формуле
где с - количество 0,1 н раствора тиосульфата, израсходованное на титрование контрольной пробы («слепой опыт»), - количество 0,1 н раствора тиосульфата,
израсходованное при титровании опытного образца, к - поправочный коэффициент к титру приблизительно 0,1 н раствора тиосульфата; 0,01269 - титр раствора тиосульфата по иоду; н - навеска масла, г.
Перекисное число.
Общие сведения. Непредельные жирные кислоты легко подвержены окислению. Этот процесс протекает под воздействием кислорода воздуха, влаги, света и катализируется ферментом липоксигеназой (липооксидазой).
Перекиси - неустойчивые соединения. Они легко распадаются с образованием окисей и освобождением атомарного кислорода. Атомарный кислород в свою очередь служит источником образования озона и перекиси водорода.
В дальнейшем перекиси и окиси превращаются в оксикислоты.
Выделившийся озон окисляет новые молекулы непредельных кислот. Образуются нестойкие соединения, озониды, которые гидролитически расщепляются, превращаясь в альдегиды.
Вот почему определение содержания перекисей и альдегидов может оказать большую помощь при суждении о качестве растительного масла.
Определение перекисного числа. Количественное определение перекисей в растительном масле основано на реакции выделения иода перекисями из иодистого калия в кислой среде
Иод оттитровывают раствором тиосульфата.
Реактивы: а) растительное масло (лучше прогорклое); б) уксусная кислота, ледяная; в) хлороформ, химический чистый (лучше - для наркоза); г) калий иодистый, насыщенный раствор. Готовится перед употреблением; д) тиосульфат натрия (гипосульфит, серноватистокислый натрий), 0,002 н раствор. Готовят перед употреблением из 0,1 н раствора: в мерную колбу на 250 мл с помощью пипетки вносят 5 мл 0,1 н раствора и
доводят до метки прокипяченной (и затем охлажденной до 20° С) дистиллированной водой; е) крахмал, 0,5%-ный раствор.
В конической колбе или склянке с притертой пробкой емкостью 200 мл отвешивают (на аналитических весах) около 2 г масла. Навеску растворяют в 20 мл смеси ледяной уксусной кислоты и хлороформа (2:1 по объему), прибавляют 5 мл насыщенного раствора иодистого калия, сосуд укупоривают пробкой и ставят в темное место на 10 мин., после чего доливают 50 мл дистиллированной воды и оттитровывают выделившийся иод 0,002 н раствором тиосульфата (индикатор - крахмал). Одновременно проводят также контрольное определение (без масла).
Перекисное число п. ч. (количество граммов иода, выделенное перекисями, содержащимися в 100 г масла) рассчитывают по формуле
где с - количество 0,002 н раствора тиосульфата, израсходованное при контрольном определении, - количество 0,002 н раствора тиосульфата, израсходованное при титровании опытного образца, мл; k - поправочный коэффициент раствора тиосульфата; 0,0002538 - титр 0,002 н раствора тиосульфата по иоду (1 мл раствора соответствует 0,0002538 г иода); н - навеска масла, г.
Качественная реакция на альдегиды (с реактивом Шиффа).
Одной из наиболее специфичных является реакция альдегидов с фуксинсернистой кислотой (реактивом Шиффа). Бесцветный раствор фуксинсернистой кислоты под влиянием альдегидов принимает красно-фиолетовое или сине-фиолетовое окрашивание.
Реакция протекает по следующей схеме:

Реактивы. Реактив Шиффа; можно готовить двумя способами: а) 0,5 г фуксина растворяют в 500 мл воды и фильтруют. 500 мл воды насыщают сернистым ангидридом. Оба раствора сливают вместе и оставляют на 10-12 ч. Хранят в темном месте; б) в мерную колбу емкостью 250 мл вливают 30 мл 0,1%-ного спиртового раствора фуксина, добавляют 15 мл 32%-ного водного раствора сернистокислого натрия воды. Содержимое колбы осторожно перемешивают и оставляют на 1 ч, после чего прибавляют 16 мл разведенной серной кислоты (1:3) и доливают до метки 50%-ным этиловым спиртом. Хранят в склянке темного стекла или темном месте. При исследовании масел предпочтительнее пользоваться реактивом, приготовленным по второму способу.
В пробирку наливают 5-6 мл масла, добавляют 2-3 мл реактива Шиффа и взбалтывают. В случае наличия альдегидов жидкость окрасится в сине-фиолетовый или красно-фиолетовый цвет. Максимум окрашивания развивается через 15-16 мин. Если окраска не появляется через 20 мин. после начала опыта, то это свидетельствует об отсутствии альдегидов в масле.
Разделение и идентификация высших предельных жирных кислот с помощью хроматографии на бумаге.
Общие сведения. С помощью описываемого метода
можно разделить и идентифицировать высшие предельные (насыщенные) жирные кислоты, в состав которых входит от 12 до 24 атомов углерода.
Общая методика разделения органических веществ на бумаге описана выше (см. «Распределительная хроматография аминокислот на бумаге»).
Для хроматографирования жирных кислот применяют специально подготовленную гидрофобную бумагу. Высшие жирные кислоты являются гидрофобными веществами, поэтому при хроматографировании исключается применение воды в качестве неподвижной фазы. Роль подвижной фазы обычно выполняет ледяная уксусная кислота или смесь уксусной кислоты с муравьиной и водой (30: 10: 1).
Метчики: пальмитиновая, стеариновая и другие высшие предельные жирные кислоты.
Подготовка хроматографической бумаги. Бумагу промывают 0,5%-ным раствором соляной кислоты в течение 3 мин., после чего 5-6 раз дистиллированной водой, 3 раза этиловым спиртом и 4-5 раз диэтиловым эфиром, затем высушивают на воздухе (работу проводят под тягой, при выключенных нагревательных приборах, соблюдая при этом противопожарные мероприятия).
Промытую и высушенную бумагу разрезают на полоски шириной 1-2 см и длиной 30-35 см. Один край каждой полоски прокалывают иголкой с ниткой, образуя петлю. Для гидрофобизации полоски опускают в цилиндр с притертой пробкой, на дно которого (слоем высотой в 4-6 см) налит бензольный раствор вазелинового масла. Нитяные петли подводят под пробку и сосуд плотно укупоривают. Полоски вынимают, когда раствор дойдет до верхнего края бумаги (на 1 см до петли), и высушивают при комнатной температуре (в вытяжном шкафу). При обработке керосином полоски погружают в жидкость на 1 мин., потом вынимают, отжимают роликом между двумя листами фильтровальной бумаги и высушивают в висячем положении при комнатной температуре (в вытяжном шкафу).
Выделение смеси жирных кислот. В коническую колбу вносят 2-3 г жира и добавляют 20- 25 мл 25%-ного спиртового раствора едкого кали. Колбу плотно закрывают пробкой с обратным холодильником, ставят на кипящую водяную баню и проводят омыление жира в течение 35-40 мин. К раствору мыла в колбе прибавляют 25-30 мл горячей воды и перемешивают. Раствор переливают в выпарительную чашку и нагревают на горячей водяной бане (температура воды не выше 85° С) до полного исчезновения запаха спирта. К жидкости в чашке добавляют несколько миллилитров раствора серной кислоты (1:3) до полного выделения слоя жирных кислот. Содержимое чашки осторожно переливают в делительную воронку. Отделяют водно-кислотный слой, а слой жирных кислот несколько раз промывают теплой водой до нейтральной реакции промывных вод по метилоранжу. Промытый слой жирных кислот фильтруют через сухую фильтровальную бумагу в темную склянку с притертой пробкой и хранят в холодильнике.
Для хроматографирования готовят раствор жирных кислот в толуоле или ацетоне, или метиловом спирте, или смеси этилового спирта с диэтиловым эфиром. Отдельно готовят раствор метчиков (в том же растворителе). Концентрацию кислот в растворах подбирают так, чтобы в капле, нанесенной микропипеткой на бумагу, содержалось 10-25 мкг каждой кислоты.
Хроматографирование. На расстоянии 1-1,5 см от нижнего края бумажной полоски графитовым
карандашом вычерчивают прямую линию, на которую с помощью микропипетки наносят каплю испытуемого раствора. На другую такую же полоску наносят каплю раствора метчиков. Капли высушивают на воздухе.
Разделение производят в стеклянных цилиндрах с притертыми пробками при комнатной температуре. На дно цилиндра наливают ледяную уксусную кислоту или смесь уксусной кислоты, муравьиной кислоты и воды . Полоску подвешивают за нитяную петлю, которую подводят под пробку так, чтобы нижний край бумаги был погружен в жидкость на 3-5 мм.

Рис. 12. Хроматограмма жирных кислот.
После того как растворитель поднялся по бумаге на 26-28 см, полоски вынимают и высушивают при комнатной температуре, затем промывают в дистиллированной воде и снова высушивают.
В фотографическую ванночку наливают раствор основного азотнокислого висмута, в который кладут хроматограммы на 10-15 мин., затем их перекладывают в другую ванночку с дистиллированной водой, которую меняют 10-12 раз. Хорошо промытые полоски опрыскивают раствором сульфгидрата аммония (или кладут в ванночку с раствором): появляются черные пятна жирных кислот (рис. 12). Хроматограммы 5-6 раз промывают дистиллированной водой и высушивают на воздухе. Рассчитывают каждой кислоты
на опытной и контрольной хроматограммах (с метчиками) и по совпадению их мест устанавливают состав кислот испытуемого жира.
Липиды бывают простые и сложные. Простые состоят из двух компонентов (например, нейтральные жиры содержат глицерин и жирные кислоты), а сложные – более чем из двух.
К простым липидам относятся жиры (триглицеролы или нейтральные жиры) и воски. Их обязательный компонент – жирные кислоты.
Жирные кислоты (ЖК) – это монокарбоновые кислоты с одной алифатической цепью, т.е. состоящие из одной карбоксильной группы и длинного неполярного хвоста.
Жирные кислоты природных липидов, как правило, содержат четное количество атомов углерода
Жирные кислоты подразделяются на предельные (или насыщенные) и непредельные (ненасыщенные). Предельные кислоты не содержат двойных связей. Непредельные кислоты содержат одну (мононенасыщенные) или несколько (полиненасыщенные) двойных связей:
СН 3 (СН 2)nСН=СН(СН 2)nСООН – мононенасыщенные;
СН 3 (СН 2)n(СН=СНСН 2)m(СН 2)kСООН – полиненасыщенные
Двойные связи в природных полиненасыщенных жирных кислотах – изолированные (несопряженные). Как правило, связи имеют цис-конфигурацию, что придает таким молекулам дополнительную жесткость. Это имеет биологический смысл, т.к. такие молекулы входят в состав клеточных мембран.
Приведем их классификацию.
Из ненасыщенных ЖК чаще всего встречаются пальмитиновая и стеариновая.
С 16:0 – сокращенное обозначение пальмитиновой кислоты – означает, что у нее 16 атомов углерода и нет двойных связей.
СН 3 (СН 2) 14 СООН – другое обозначение пальмитиновой кислоты
С 18:0 – стеариновая, СН 3 (СН 2) 16 СООН
Кроме того, выделяются следующие насыщенные жирные кислоты:
С 12:0 – лауриновая;
С 14:0 – миристиновая;
С 20:0 – арахиновая;
С 22:0 – бегеновая;
С 24:0 – лигноцериновая.
Моноеновые:
С 16: 1 – пальмитоолеиновая
СН 3 (СН 2) 5 СН=СН(СН 2) 7 СООН;
С 18:1 – олеиновая
СН 3 (СН 2) 7 СН=СН(СН 2) 7 СООН.
Положение двойной связи относительно карбоксильной группы обозначают знаком ∆ 9 , где число показывает порядковый номер атома углерода, возле которого находится двойная связь. Таким образом, названные кислоты могуть быть обозначены соответственно С 16:1 , ∆ 9 и С 18:1 , ∆ 9 .
Полиеновые кислоты чаще всего бывают с двумя и тремя двойными связями:
С 18:2 , ∆ 9 – линолевая, СН 3 (СН 2) 4 (СН=СНСН 2) 2 (СН 2) 6 СООН;
С 18:3 , ∆ 9 – линоленовая, СН 3 СН 2 (СН=СНСН 2) 3 (СН 2) 6 СООН.
Иногда встречаются жирные кислоты (т.н. необычные), в алифатических цепях которых есть заместители: СН 3 -, -ОН, С=О и др.:
СН 3 (СН 2) 7 -СН-(СН 2) 8 СООН – туберкулостеариновая, С 19:0 , из туберкулезных палочек
СН 3 (СН 2) 5 -СН - СН(СН 2) 9 СООН – лактобацилловая С 19:0 .
Жирные кислоты нерастворимы в воде, температура плавления понижается с увеличением числа двойных связей и укорочением цепи.
Такие жирные кислоты, как линолевая, линоленовая и им подобные (с двумя и тремя двойными связями), не синтезируются внутри организма человека и называются незаменимыми. Поэтому их необходимо получать с пищей.
При этом полиеновые кислоты делят на две группы: ω-3 и ω-6 (в зависимости от положения двойной связи от углеродного атома последней, метильной группы). Эти кислоты являются предшественниками разных групп гормонов местного действия – эйкозаноидов. Так, линолевая кислота является примером ω-6 кислот. В качестве примера ω-3 кислот можно привести тимнодоновую (эйкозапентановую) кислоту, С 20:5 (ω-3). Она содержится в жире морских рыб, хотя имеет растительное происхождение, синтезируется фитопланктоном. Кроме того, такие рыбы как лосось, макрель, сельдь, сардина и др., поедая планктон, накапливают эту кислоту в своем жире. При употреблении человеком в пищу этой кислоты у него понижается свертываемость крови, что используется для профилактики сердечно-сосудистых заболеваний.
Воски
Воски – это сложные эфиры, образуемые длинноцепочечными жирными кислотами и длинноцепочечными спиртами (с числом углеродных атомов от 16 до 36). Воски широко распространены в природе. Восковое покрытие листьев и плодов растений защищает их от механических повреждений, уменьшает потери влаги, препятствует возникновению инфекции. У позвоночных воски, секретируемые кожными железами, выполняют функцию защитного покрытия, смазывающего и смягчающего кожу и предохраняющего ее от воды. Восковым секретом покрыты волосы. Перья птиц и шкура животных также имеют восковое покрытие, придающее им водоотталкивающие свойства. Воск овечьей шерсти – ланолин – широко используется в медицине и косметике как основа для приготовления мазей и кремов. Воск, вырабатываемый пчелами, служит строительным материалом сот:

Пчелиный воск
Воски являются нормальными метаболитами некоторых микроорганизмов. Природные воски наряду со сложными эфирами высших жирных кислот и высших спиртов содержат некоторое количество свободных жирных кислот, спиртов, а также углеводородов с нечетным числом атомов углерода (21-35), красящих и душистых веществ. Все воски представляют собой твердые вещества разнообразной окраски, устойчивые к действию света, окислителей, нагреванию. Температура их плавления – от 30 до 90 о С.
Нейтральные жиры (триацилглицеролы, триглицериды)
Это сложные эфиры глицерина и жирных кислот. Нейтральные жиры бывают простыми и смешанными. Простые содержат одинаковые остатки жирных кислот, смешанные – остатки разных жирных кислот. В состав нейтральных жиров могут входить как насыщенные, так и ненасыщенные жирные кислоты.
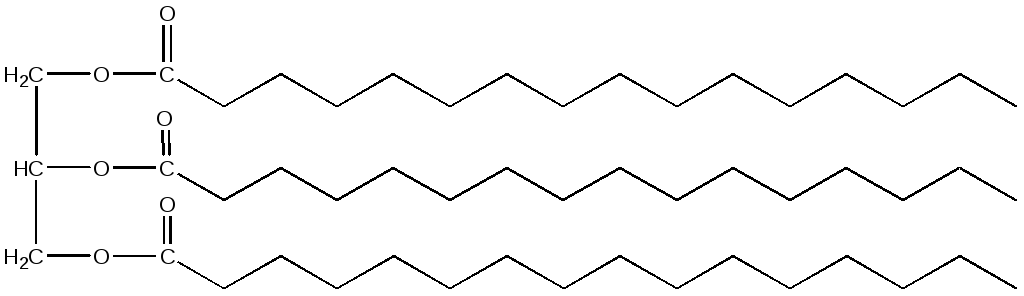
Нейтральные жиры делятся на триацилглицериды, диацилглицериды и моноацилглицериды (в зависимости от количества жирных кислот, присоединенных к глицерину). Наиболее распространены триацилглицериды. Названия триацилглицеролов образуются от названий жирных кислот, входящих в их состав. Например, триацилглицерол, содержащий три остатка пальмитиновой кислоты, будет называться трипальмитин:
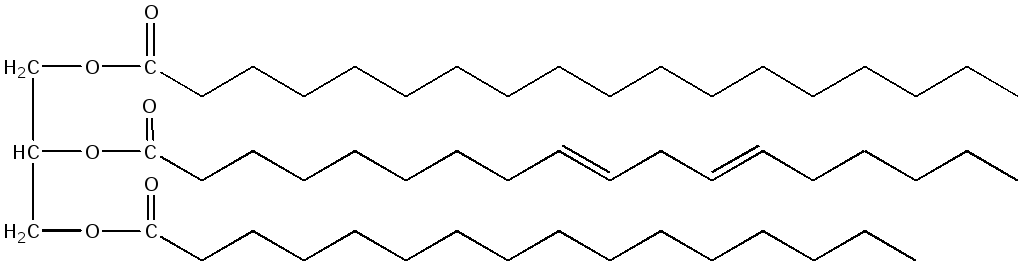
Если молекула содержит остатки различных жирных кислот, то в названии будут указаны все входящие в ее состав остатки с окончанием –оил и добавлением слова глицерол. Например, 1-стеароил, 2-линолеоил, 3-пальмитоил глицерол:
Физико-химические свойства триглицеридов определяются свойствами входящих в их состав жирных кислот. Как правило, животные триацилглицериды содержат больше насыщенных кислот, чем растительные, и поэтому тверже. Состав и качество жира характеризуются особыми параметрами, называемыми химическими константами триглицеридов:
1) йодное число – это количество граммов йода, которое связывается 100 граммами жира. Поскольку йод связывается только с двойными связями жирных кислот, йодное число характеризует степень ненасыщенности жира.
2) кислотное число – количество милиграммов гидрооксида калия, необходимое для нейтрализации 1 грамма жира. Указывает на количество свободных жирных кислот в жире.
3) число омыления ‒ количество милиграммов гидрооксида калия, необходимое для нейтрализации всех жирных кислот, свободных и связанных, входящих в состав жира.
Молекулы фосфолипидов и гликолипидов амфифильны, то есть углеводородные радикалы жирных кислот и сфингозина являются гидрофобными, а другая часть молекулы, образованная из углеводов, остатка фосфорной кислоты с присоединенным к нему холином, серином, этаноламином – гидрофильна. В результате этого в водной среде гидрофобные участки молекулы фосфолипидов вытесняются из водной среды и взаимодействуют между собой, а гидрофильные участки контактируют с водой, в результате образуется двойной липидный слой клеточных мембран (рис.9.1.). Этот двойной слой мембраны пронизан белковыми молекулами – микротрубочками. На наружной стороне мембраны прикреплены олигосахариды. Количество белка и углеводов в различных мембранах неодинаково. Белки мембран могут выполнять структурные функции, могут быть ферментами, осуществлять трансмембранный перенос питательных веществ, могут выполнять различные регуляторные функции. Мембраны всегда существуют в виде замкнутых структур (см. рис.9.1). Липидный бислой обладает способностью к самосборке. Эту способность мембран используют для создания искусственных липидных пузырьков – липосом.
Липосомы широко применяются как капсулы для доставки различных лекарственных веществ, антигенов, ферментов в различные органы и ткани, так как липидные капсулы способны проникать через клеточные мембраны. Это позволяет направлять лекарственные вещества точно по адресу в пораженный орган.
Рис.9.1. Схема клеточной мембраны из двойного липидного слоя. Гидрофобные участки молекулы липидов притягиваются между собой; гидрофильные участки молекулы находятся с наружной стороны. Молекулы белков пронизывают липидный бислой.
Обмен липидов
В организме нейтральные жиры находятся в 2-х формах: запасного жира и протоплазматического жира.
В состав протоплазматического жира входят фосфолипиды и липопротеиды. Они участвуют в формировании структурных компонентов клеток. Мембраны клеток, митохондрий и микросом состоят из липопротеидов и регулируют проницаемость отдельных веществ. Количество протоплазматического жира стабильно, и не изменяется в зависимости от голодания или ожирения.
Запасной (резервный) жир – в его состав входят триацилглицерины жирных кислот – находится в подкожной жировой клетчатке и в жировых депо внутренних органов.
Функции резервного жира заключаются в том, что это -запасной источник энергии, доступной для использования в период голодания; это – изоляционный материал от холода, от механических травм.
Важно также, что липиды, распадаясь, выделяют не только энергию, но и значительное количество воды:
При окислении 1 грамма белка выделяется – 0,4 г; углеводов – 0,5 г; липидов – 1 г воды. Это свойство липидов имеет большое значение для животных, обитающих в условиях пустыни (верблюды).
Переваривание липидов в желудочно-кишечном тракте
В полости рта липиды подвергаются лишь механической обработке. В желудке имеется небольшое количество липазы, которая гидролизует жиры. Малая активность липазы желудочного сока связана с кислой реакцией содержимого желудка. Кроме того, липаза может влиять только на эмульгированные жиры, в желудке отсутствуют условия для образования эмульсии жира. Только у детей и у моногастричных животных липаза желудочного сока играет важную роль в переваривании липидов.
Кишечник является основным местом переваривания липидов. В двенадцатиперстной кишке на липиды воздействует желчь печени и сок поджелудочной железы, одновременно происходит нейтрализация кишечного содержимого (химуса). Происходит эмульгирование жиров под действием желчных кислот. В состав желчи входят: холевая кислота, дезоксихолевая (3,12 дигидроксихолановая), хенодезоксихолевая (3,7 дигидроксихолановая) кислоты, натриевые соли парных желчных кислот: гликохолевая, гликодезоксихолевая, таурохолевая, тауродезоксихолевая. Они состоят из двух компонентов: холевой и дезоксихолевой кислот, а также глицина и таурина.

дезоксихолевая кислота хенодезоксихолевая кислота
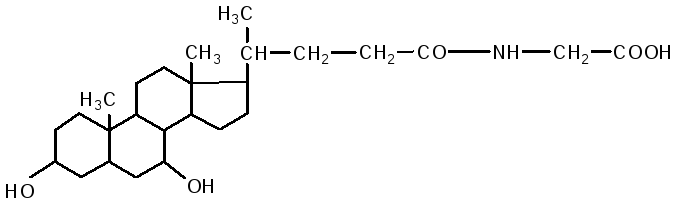
гликохолевая кислота
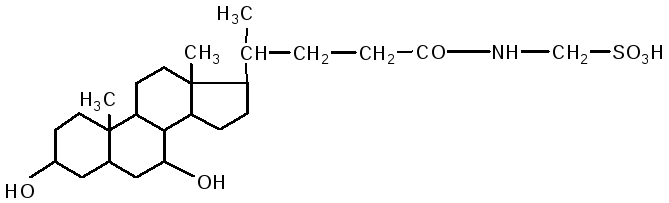
таурохолевая кислота
Соли желчных кислот хорошо эмульгируют жиры. При этом увеличивается площадь соприкосновения ферментов с жирами и увеличивается действие фермента. Недостаточность синтеза желчных кислот или задержка поступления нарушает эффективность действия ферментов. Жиры, как правило, всасываются после гидролиза, но часть тонко эмульгированных жиров всасывается через стенку кишечника и переходит в лимфу без гидролиза.
Эстеразы разрывают в жирах эфирную связь между, спиртовой группой и карбоксильной группой карбоновых кислот и неорганических кислот (липаза, фосфатазы).
Под действием липазы жиры гидролизуются на глицерин и высшие жирные кислоты. Активность липазы возрастает под действием желчи, т.е. желчь непосредственно активирует липазу. Кроме того, активность липазы увеличивают ионы Са ++ вследствие того, что ионы Са ++ образуют нерастворимые соли (мыла) с освободившимися жирными кислотами и предотвращают их подавляющее влияние на активность липазы.
Под действием липазы в начале гидролизуются эфирные связи у α и α 1 (боковых) углеродных атомов глицерина, затем у β-углеродного атома:

Под действием липазы до 40% триацилглицеридов расщепляются до глицерина и жирных кислот, 50-55% гидролизуется до 2-моноацилглицеринов и 3-10% не гидролизуется и всасываются в виде триацилглицеринов.
Стериды корма расщепляются ферментом холестеролэстеразой до холестерина и высших жирных кислот. Фосфатиды гидролизуются под влиянием фосфолипаз А, A 2 , С и D. Каждый фермент действует на определенную сложноэфирную связь липида. Точки приложения фосфолипаз представлены на схеме:
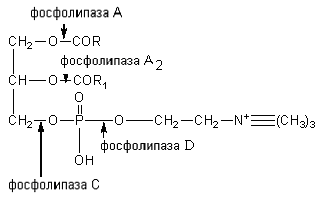
Фосфолипазы поджелудочной железы, тканевые фосфолипазы вырабатываются в виде проферментов и активируются трипсином. Фосфолипаза A 2 змеиных ядов катализирует отщепление ненасыщенной жирной кислоты в положении 2 фосфоглицеридов. При этом образуются лизолецитины с гемолитическим действием.
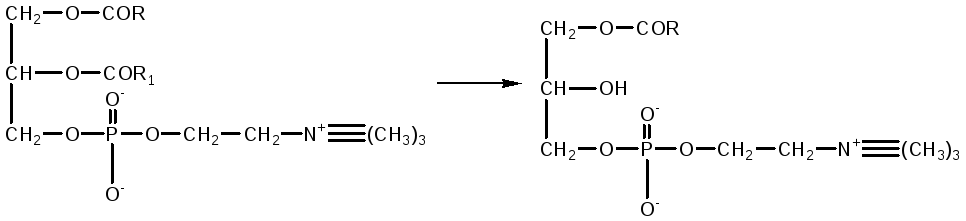
фосфотидилхолин лизолецитин
Поэтому при попадании этого яда в кровь происходит сильный гемолиз.. В кишечнике эта опасность устраняется действием фосфолипазы A 1 , быстро инактивирующей лизофосфатид в результате отщепления от него остатка насыщенной жирной кислоты с превращением его в неактивный глицерофосфохолин.
Лизолецитины в малых концентрациях стимулируют дифференцировку лимфоидных клеток, активность протеинкиназы С, усиливают клеточную пролиферацию.
Коламинфосфатиды и серинфосфатиды расщепляются фосфолипазой А до лизоколаминфосфатидов, лизосеринфосфатидов, которые далее расщепляются фосфолипазой A 2 . Фосфолипазы С и D гидролизуют связи холина; коламина и серина с фосфорной кислотой и остатка фосфорной кислоты с глицерином.
Всасывание липидов происходит в тонком отделе кишечника. Жирные кислоты с длиной цепи менее 10 углеродных атомов всасываются в неэтерифицированной форме. Для всасывания необходимо присутствие эмульгирующих веществ – желчных кислот и желчи.
Ресинтез жира, характерного для данного организма, происходит в кишечной стенке. Концентрация липидов в крови в течение 3-5 часов после приема корма высокая. Хиломикроны – мелкие частицы жира, образующиеся после всасывания в кишечной стенке, представляют собой липопротеиды, окруженные фосфолипидами и белковой оболочкой, внутри содержат молекулы жира и желчных кислот. Они поступают в печень, где липиды подвергаются промежуточному обмену, а желчные кислоты проходят в желчный пузырь и далее обратно в кишечник (см. рис.9.3 на стр.192). В результате такого кругооборота теряется малое количество желчных кислот. Считают, что молекула желчной кислоты в сутки совершает 4 кругооборота.
Ацилглицеролы, или нейтральные липиды, - наиболее распространенная в природе группа липидов. Эти соединения представляют собой сложные эфи-ры жирных кислот и трехатомного спирта глицерола (глицериды), в котором могут быть этерифицированы одна, две или три гидроксильные группы глицерола с образованием соответственно моно-, ди- и триацилглицеролов:
В природе наиболее часто встречаются триацилглицеролы. Поскольку все приведенные выше ацилглицеролы не содержат ионных групп, они относятся к нейтральным липидам. Если все три кислотных радикала принадлежат одной и той же жирной кислоте, то такие триацилглицеролы называют простыми, если же разным жирным кислотам, - то смешанными.
Жирные кислоты, входящие в состав триацилглицеролов, определяют их физико-химические свойства. Чем больше в липидах остатков короткоцепо-чечных и ненасыщенных кислот, тем ниже температура плавления и выше растворимость. Так, животные жиры обычно содержат значительное количество насыщенных жирных кислот, благодаря чему они при комнатной температуре остаются твердыми. Жиры, в состав которых входит много ненасыщенных кислот, будут при этих условиях жидкими; их называют маслами.
Большинство животных жиров содержат в различных соотношениях эфиры пальмитиновой, стеариновой, пальмитоолеиновой, олеиновой и линоле-новой кислот. В жире человека, плавящемся при 15 °С, содержится около 70% ненасыщенных жирных кислот, и при температуре тела он находится в жидком состоянии. Жиры из различных тканей одного организма так же, как и растительные масла, могут различаться между собой как длиной углеводородных цепей, так и степенью их ненасыщенности.
Для характеристики свойств жира используют константы, или жировые числа, - кислотное число, число омыления, йодное число.
Общим структурным фрагментом всех фосфоглицеридов является фосфатидная кислота (1,2-диацил,3-фосфоглицерол).
Фосфатидная кислота образуется в организме в процессе биосинтеза триацилгл и неролов и фосфоглицеридов как общий промежуточный метаболит; в тканях она присутствует в незначительных количествах. Следует отметить, что все природные фосфоглицериды относятся к L-ряду. Различные фосфоглицериды отличаются друг от друга дополнительными группировками, присоединенными фосфоэфирной связью к фосфатидной кислоте, т.е. R3. Состав жирных кислот различных фосфоглицеридов различается даже в пределах одного организма и наряду с замещающими группировками определяет специфичность фосфолипидов:
Фосфатидилхолин (лецитин). В своем составе содержит аминоспирт хо-лин (гидроксид 3-гидроксиэтилтриметиламмония):
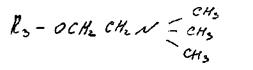 |
Фосфатидилэтаноламин (кефалин). В состав фосфатидилэтаноламинов вместо холина входит азотистое основание этаноламин НО-СН 2 -СН 2 -NH 3 .
В организме животных и в высших растениях в наибольшем количестве встречаются фосфатидилхолины и фосфатидилэтаноламины. Эти две группы глицерофосфолипидов являются главными липидными компонентами мембран клеток.
Фосфатидилинозиты В отличае от других групп фосфоглицеридов в состав фосфатидилинозитов вместо азотосодержащих соединений входит 6-углеродный циклический спирт инозитол, представленный одним из его стереоизомеров- монозитолом.
Фосфатидилглицерины. Так же как фосфатидилинозиты, фосфатидилглицерины не содержит азотсодержащего соединения. В этих соединениях полярной группой служит еще одна молекула глицерола.










